انواع محیط کشت میکروبی و اصول تهیه آنها
 میکروارگانیسم ها همانند سایر موجودات زنده برای ادامه زندگی به محیط زیست نیاز دارند که مواد لازم جهت متابولیسم و تکثیر آنها را دارا باشد.ضمنا این محیط باید دارای دما,فشار اسمزی و PH مناسب نیز در حدود ۲/۷ باشد.میکروارگانیسم ها علاوه بر محیط های زیست طبیعی خود توانایی زندگی در محیط های ساخته شده را نیز دارند که آنها را محیط کشت مصنوعی می نامند.
میکروارگانیسم ها همانند سایر موجودات زنده برای ادامه زندگی به محیط زیست نیاز دارند که مواد لازم جهت متابولیسم و تکثیر آنها را دارا باشد.ضمنا این محیط باید دارای دما,فشار اسمزی و PH مناسب نیز در حدود ۲/۷ باشد.میکروارگانیسم ها علاوه بر محیط های زیست طبیعی خود توانایی زندگی در محیط های ساخته شده را نیز دارند که آنها را محیط کشت مصنوعی می نامند.
انواع محیط کشت
محیط های کشتی که در میکروب شناسی به کار برده می شوند انواع مختلف دارند و آنها را می توان از جنبه های گوناگون از جمله حالت و از نظر متمایز سازی تقسیم بندی کرد.
انواع محیط کشت از نظر حالت
۱-محیط کشت جامد (Solid ):
این محیط کشت دارای پسوند آگار می باشد چرا که به نسبت ۲ تا ۳ درصد حاوی آگار بوده و همین میزان آگار می تواند باعث جامد شدن یک محیط کشت جامد گردد.آگار تجارتی ماده خشک است شبیه سلولز که اگر در آب سرد ریخته شود باد می کند و اگر بجوشد کاملا حل می شود در عین حال در کمتر از ۴۵ ذرجه سانتی گراد به حالت جامد درمی آید.آگار به حد کافی مواد غذایی ندارد و باید آن را با مواد غذایی دیگر مخلوط کرده و مورد استفاده قرار داد نوترین آگار مثالی از یک محیط کشت جامد است.
محیط کشت نیمه جامد (semisolid):
این نوع محیط کشت به وسیله اضافه کردن ۱ تا ۵/۱ درصد آگار به محیط کشت مایع کشت دارای پسوند مدیوم (medium) می باشد مثل SIM (sulfide-Indol-Motility )مدیوم که از آن می توان برای بررسی حرکت باکتری ها استفاده کرد.
محیط کشت مایع : (Fluid ) :
این نوع محیط کشت دارای پسوند براث (Broth) است و حالت جامد یا ژله ای ندارد از این نوع محیط می توان نوترین براث را نام برد.
انواع محیط کشت از نظر متمایز سازی:
محیط های کشت مختلف برای تشخیص و جداسازی باکتری ها به کار می روند بر چهار نوع اند:
۱-محیط های کشت عمومی(ساده):
این محیط ها دارای کلیه مواد لازم جهت رشد باکتری ها هستند و به علت نداشتن مواد ضد میکروبی تقریبا تمام باکتری ها می توانند در آن رشد کنند.محیط کشت نوترین آگار از این نوع محیط کشت است.
۲-محیط های کشت غنی شده:
این محیط ها به واسطه اضافه کردن خون یا سرم به محیط های کشت ساده فراهم می شوند.این محیط ها می توانند رشد یک سری باکتری های پر نیاز را فراهم کنند مثل محیط بلاد آگار یا سرم لفلر که مورد اخیر جهت کشت باسیل دیفتری به کار می رود.
۳-محیط های کشت افتراقی:
این محیط ها به علت داشتن یک سری مواد ویژه و در عین حال ضد میکروبی باعث تمایز برخی از باکتری ها می شوند مانند محیط ائوزین متیلن بلو(E.M.B ) و مک کانکی که حاوی لاکتوز و معرف های شیمیایی هستند و به همین علت باعث تمایز باکتری هایی می شوند که لاکتوز را تخمیر می کنند.همچنین محیط هایی مثل سلینت F و تتراتیونات براث وجود دارند که رشد باکتری سالمونلا را در نمونه مدفوع افزایش داده و از رشد دیگر باکتری ها جلوگیری می نمایند.
۴-محیط های کشت اختصاصی (انتخابی):
این محیط ها فقط برای رشد باکتری های ویژه ای مناسبند مثلا در محیط کشت مانیتول سالت آگار (Manitol Salt Agar )که دارای قند مانیتول و مقدار زیادی نمک ۵/۷ درصد است فقط باکتری هایی قادر به رشد هستند که اولا مانیتول را تخمیر کنند ثانیا در مقابل غلظت زیاد نمک طعام مقاوم باشند مانند باکتری استافیلوکوک بیماری زا که تین توانایی را داراست.
اصول تهیه محیط کشت:
امروزه اکثر محیط های کشت مورد استفاده در میکروب شناسی به صورت پودرهای آماده وجود دارند که برای تهیه آنها باید طبق دستور مقدار معینی از هر محیط کشت را با مقدار مناسبی آب مقطر مخلوط کرد برای این منظور ابتدا مقدار لازم را در ارلن مایر می ریزیم و مقدار پودر مشخص شده را به تدریج در آن وارد می کنیم و هم می زنیم تا پودر گلوله نشود و به طور یکنواخت حل گردد.گاهی برای تهیه محیط های کشت لازم است مقادیر معینی از مواد مختلف را با مقدار مناسبی آب مقطر مخلوط کرد.در هر صورت در مواقعی که آگار در ترکیب محیط کشت وجود دارد باید آن را در محیط حل کرد به این منظور بعد از مخلوط کردن مقدار لازم پودر و آب ضروری است که مخلوط حاصل به حدود یک دقیقه جوشانده شود تا رنگ محیط کاملا شفاف گردد به این منظور می توان از بن ماری و یا شعله مستقبم باید محیط را مرتب به هم زد تا آگار ته نگیرد و نسوزد پس از آماده شدن محیط باید آن را توسط اتوکلاو سترون کرد.در مورد برخی از محیط های اختصاصی مثلا سالمونلا –شیگلا-آگار سترون کردن محیطط لازم نیست. اگر منظور تهیه محیط کشت در پلیت باشد محیط را در همان ارلن مایری که تهیه کرده ایم در داخل اتوکلاو به مدت ۱۵ الی ۲۰ دقیقه استریل می کنیم پس از بیرون آوردن ارلن حاوی محیط کشت از داخل اتوکلاو اجازه می دهیم تا دمای آن حدود بین ۴۵ تا ۵۰ درجه سانتی گراد کاهش یلبد سپس در کنار شعله با رعایت شرایط سترون به مقدار ۱۰ تا ۱۵ سی سی در هر پلیت تقسیم می کنیم و سپس سطح محیط داخل هر پلیت را به منظور از بین بردن حبابهای احتمالی هوا توسط شعله تیز شعله دهی می کنیم.
برای تهیه محیط کشت در لوله آزمایش باید پس از مخلوط کردن و حرارت دادن مقدار پودر و آب مقطر مشخص در داخل ارلن محیط مذکور را در داخل لوله های آزمایش تقسیم نمود . معمولا تا ۱/۳ لوله ها را از محیط کشت پر می نمایند و سپس آنها را اتوکلاو می کنند.اگر منظور تهیه محیط آگار شیب دار باشد باید لوله ها را بعد از خارج کردن اتوکلاو به طور کج قرار داد تا محیط کشت بسته شود . برای تهیه محیط آگار تال (agartall ) مثل SIM لوله را به طور عمودی قرار می دهند تا محیط ببندد . در هر حال در تمام موارد باید دهانه لوله ها یا ارلن ها را قبل از اتوکلاو کردن خوب مسدود کرد و پنبه را به نحوی در دهانه لوله ها گذاشت که مقداری از آن در داخل لوله و مقداری هم در بیرون قرار بگیرد به طوری که به راحتی بتوان آن را برداشت .(در هر صورت نباید آنقدر شل باشد که به آسانی بیفتد.) در نهایت محیط های پلیتی و لوله ای را به مدت ۲۴ ساعت قرار دادن در انکوباتور به منظور چک کردن آلوده بودن یا نبودن آنها به طور وارونه قرار می دهند . محیط ها را تا هنگام مصرف باید به طور وارونه در یخچال نگه داشت تا از تبخیر آب آنها جلوگیری شود.این محیط های کشت در صورت نگه داری در یخچال تا یک هفته قابل استفاده اند

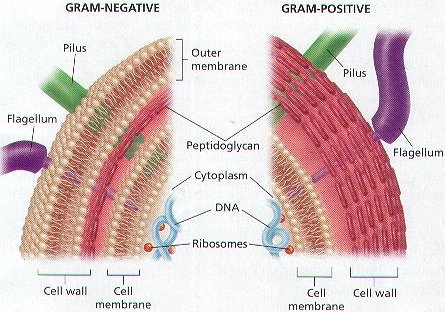
 زی درباکتری شناسی است که اولین بار توسط کریسین گرم ابداع شد . دراین رنگ آمیزی باکتریها بر مبنای رنگ باکتری پس ازرنگ آمیزی به دودسته گرم مثبت وگرم منفی تقسیم می شوند . رنگ باکتری پس ازرنگ آمیزی به توانایی حفظ رنگ اول وبه عبارتیبه ساختمان دیواره سلولی باکتری بستگی دارد . دررنگ آمیزی گرم باکتریهای گرم مثبت پس ازرنگ آمیزی به رنگ بنفش وباکتری های گرم منفی به رنگ قرمز مشاهده می شود
زی درباکتری شناسی است که اولین بار توسط کریسین گرم ابداع شد . دراین رنگ آمیزی باکتریها بر مبنای رنگ باکتری پس ازرنگ آمیزی به دودسته گرم مثبت وگرم منفی تقسیم می شوند . رنگ باکتری پس ازرنگ آمیزی به توانایی حفظ رنگ اول وبه عبارتیبه ساختمان دیواره سلولی باکتری بستگی دارد . دررنگ آمیزی گرم باکتریهای گرم مثبت پس ازرنگ آمیزی به رنگ بنفش وباکتری های گرم منفی به رنگ قرمز مشاهده می شود